「硫酸」:各本之異
| [底本] | [底本] |
刪去的內容 新增的內容
細無編輯摘要 |
細 →製 |
||
| 第一九行: | 第一九行: | ||
==製== |
==製== |
||
欲製硫酸,現有濕硫酸法、接觸法,古有鉛室法 |
|||
===接觸法=== |
|||
燒[[硫]]而得[[二氧化硫]] |
|||
: S (s) + O<sub>2</sub> (g) → SO<sub>2</sub> (g) |
|||
用五氧化二釩作催化劑,二氧化硫並[[氧]]得三氧化硫 |
|||
: 2SO<sub>2</sub> (g)+ O<sub>2</sub> (g) → 2SO<sub>3</sub> (g) |
|||
三氧化硫並硫酸得發煙硫酸 |
|||
: H<sub>2</sub>SO<sub>4</sub> (l) + SO<sub>3</sub> (g)→ H<sub>2</sub>S<sub>2</sub>O<sub>7</sub> |
|||
再加水得硫酸 |
|||
: H<sub>2</sub>S<sub>2</sub>O<sub>7</sub> (l) + H<sub>2</sub>O (l) → 2 H<sub>2</sub>SO<sub>4</sub> (l) |
|||
===濕硫酸法=== |
|||
燒[[硫]]而得[[二氧化硫]] |
|||
: S (s) + O<sub>2</sub> (g) → SO<sub>2</sub> (g) |
|||
用五氧化二釩作催化劑,二氧化硫並[[氧]]得三氧化硫 |
|||
: 2SO<sub>2</sub> (g)+ O<sub>2</sub> (g) → 2SO<sub>3</sub> (g) |
|||
三氧化硫加水得氣態硫酸 |
|||
: SO<sub>3</sub> + H<sub>2</sub>O → H<sub>2</sub>SO<sub>4</sub>(g) |
|||
氣態硫酸凝結為液體硫酸 |
|||
: H<sub>2</sub>SO<sub>4</sub>(g) → H<sub>2</sub>SO<sub>4</sub>(l) |
|||
===實驗室中=== |
|||
燒[[硫]]而得[[二氧化硫]] |
|||
: S (s) + O<sub>2</sub> (g) → SO<sub>2</sub> (g) |
|||
加雙氧水而生硫酸 |
|||
: SO<sub>2</sub> + H<sub>2</sub>O<sub>2</sub> → H<sub>2</sub>SO<sub>4</sub> |
|||
==意外處理== |
==意外處理== |
||
二〇一三年八月二七日 (二) 〇八時五二分審
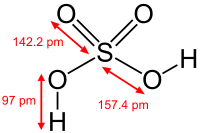

硫酸者(化學式︰H2SO4),偏分子化合物也,屬酸,性烈。又曰漒水、鏹水、綠礬油。三酸兩鹼處一焉。
故謂綠礬油,蓋餾綠礬(硫酸亞鐵,硫酸成鹽之一也。)出油,故名之。
有用實蕃,古人譽曰「化學工業之母」也。
性
硫酸者,可溶於水中而釋氫離子,可通電,故為電解質。
- 狀:純者稠而似油。
- 味:一說無味,一說少甘。
- 密度:一點八四公克每毫升。
- 熔沸點:熔點十點四攝氏度。沸點,純者二百九十攝氏度,零點九八者[一]三百三十八攝氏度。
- 吸水性:濃者遇水生溫,放熱。
- 脫水性:濃者遇物之有氫氧者,則奪之以為水也。
- 氧化性:濃者則然。
製
欲製硫酸,現有濕硫酸法、接觸法,古有鉛室法
接觸法
- S (s) + O2 (g) → SO2 (g)
用五氧化二釩作催化劑,二氧化硫並氧得三氧化硫
- 2SO2 (g)+ O2 (g) → 2SO3 (g)
三氧化硫並硫酸得發煙硫酸
- H2SO4 (l) + SO3 (g)→ H2S2O7
再加水得硫酸
- H2S2O7 (l) + H2O (l) → 2 H2SO4 (l)
濕硫酸法
- S (s) + O2 (g) → SO2 (g)
用五氧化二釩作催化劑,二氧化硫並氧得三氧化硫
- 2SO2 (g)+ O2 (g) → 2SO3 (g)
三氧化硫加水得氣態硫酸
- SO3 + H2O → H2SO4(g)
氣態硫酸凝結為液體硫酸
- H2SO4(g) → H2SO4(l)
實驗室中
- S (s) + O2 (g) → SO2 (g)
加雙氧水而生硫酸
- SO2 + H2O2 → H2SO4
意外處理
其之濺身,當以乾布拭去,并輔以小蘇打。勿以水,其遇水生熱而將灼傷也。
用
反應
複分解反應:如:2NaOH+H2SO4===Na2SO4+2H2O以彰酸之通性
